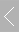
原位红外光谱探测CO2电催化还原反应
目录
1. 几种原位电化学红外附件构造
1.1 IRAS
1.2 衰减全反射原理
1.3 内反射ATR-SEIRAS和内反射Otto薄层模式
2. 实验注意事项
2.1 内外反射的选择依据
2.2 晶体选择
2.3 入射角度
2.4 正峰和倒峰
2.5 光路的选择
2.6 电化学池的选择,单室和双室,流动和静止
2.7 表面增强红外注意事项
2.8 电化学测试方法的选择
2.9 环境或电解液相关物种谱峰归属
2.10 光学部件的吹扫
2.11 电极预处理
3. 红外光谱探测CO2还原应用案例概述
3.1 检测各种中间体
3.1.1 CO中间体
3.1.2 COOH,COO-中间体
3.1.3 OCCO,OCCOH中间体
3.1.4 CHO中间体
3.2 电解液的影响(电极界面微环境的探测)
3.2.1 阴离子的影响
3.2.2 阳离子的影响
3.2.3 pH值的计算
3.3.4 添加剂的影响
4. 展望
4.1 与DEMS联用
4.2 外反射和otto薄层构造流动池
4.3 MEA电极的原位红外探测
5. 参考文献
原位红外光谱探测水系CO2电催化还原反应过程注意事项
1. 几种原位电化学红外构造简介
利用分子振动的特征吸收,红外光谱可以用于原位检测固体电极上的吸附态物种,从而:(1) 关键中间产物的识别和构型鉴定(2)确定电极表面成键状态(3)优先的反应路径和选择性确认(4)探究反应环境的影响,如电解液阴离子,阳离子,pH, 添加剂等(5)电极电解液界面双电层的探测。适用于水系或非水系电催化反应,如CO2RR, HER, OER, ORR, MOR, EOR, NRR,硝酸根还原,有机电合成等。
1.1 IRAS
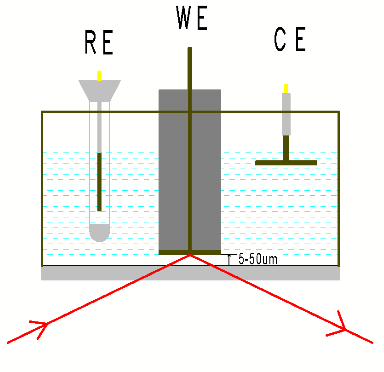
IRAS或IRRAS,也称为外反射模式,或透反射模式,光滑电极(玻碳电极,光滑金属电极或FTO等基底)或将电催化剂滴涂或电沉积到光滑电极上,压到红外窗口上形成一层电解液薄层(1-10微米),红外光束穿过光学窗口经过电解液薄层,然后在电极表面反射红外光,最后到达红外检测器。 外反射模一般选用CaF2窗片,窗片的形状一般为厚度2mm左右的圆片,梯形、半球形或半圆柱型的晶体也经常被使用。
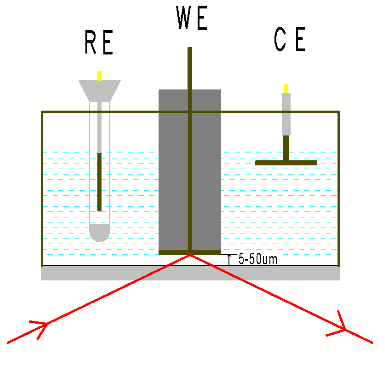
图1 外反射示意图 图2 ATR原理示意图
1.2衰减全反射原理的理解
衰减全反射基本原理:红外光经过折射率大的晶体再入射到折射率小的试样表面上,当入射角大于临界角时,入射光线就会产生全反射。 事实上红外光并不是全部被反射回来,而是穿透到试样表面内一定深度后再返回表面在该过程中,试样在入射光频率区域内有选择吸收,反射光强度发生减弱,产生与透射吸收相类似图,从而获得样品表层化学成份的结构信息。 见图2 ATR原理示意图。 红外光穿透晶体界面的深度与晶体折射率和入射光角度有关,常见晶体的折射率见表2,折射率越大,穿透深度越小。
1.3 内反射ATR-SEIRAS和内反射Otto薄层模式
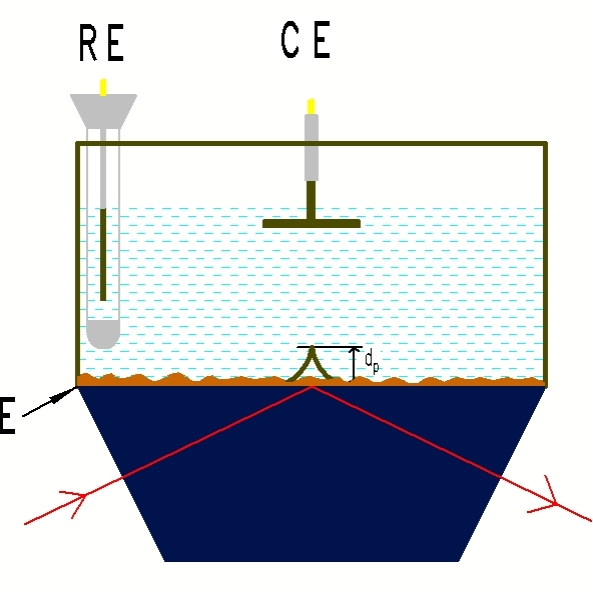
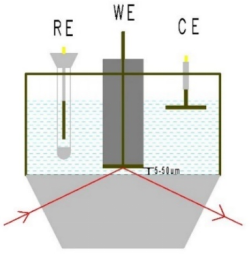
图3 内反射ATR-SEIRAS 图4 内反射Otto薄层模式
内反射ATR-SEIRAS模式,也称为Kretschmann构造,如上图所示,ATR晶体(ZnSe, Si, Ge)平面上化学镀或真空镀一层岛状金属膜,在金属膜上底涂或电沉积催化剂,金属膜作为导电基底,同时作为表面增强剂,使催化剂表面吸附分子的红外信号会比没有金属膜时的信号增强10-1000倍。 这称为表面增强红外效应,即SEIRAS。 不同晶体耐受不同范围pH,光谱范围也不同,详见表2
内反射Otto薄层模式,与外反射构造类似,区别是内反射Otto薄层模式下一般选用ZnSe,Ge,Si,金刚石等衰减全反射晶体,是基于ATR的反射原理,见图4。
2. 实验注意事项
2.1 内外反射的选择依据
电化学池
|
可选晶体 |
传质情况 |
电场线分布情况 |
电极材料要求 |
可检测物种 |
ATR内反射Kretschmann(ATR-SEIRAS) | Diamond,Si,Ge,ZnSe | 非薄层构造,传质阻力小 |
均匀 | 金属膜+滴涂或电沉积催化剂 | 吸附态 |
ATR内反射Otto薄层模式 | Diamond,Si,Ge,ZnSe | 薄层构造,传质阻力大 |
不均匀 | 镜面光滑或粗糙表面催化剂(如碳纸或泡沫镍负载型) | 吸附态+溶液相 |
外反射薄层模式(IRRAS) | CaF2 | 薄层构造,传质阻力大 | 不均匀 | 玻碳电极等镜面光滑基底电极+滴涂或电沉积催化剂 | 吸附态+溶液相 |
表1 电化学原位红外光谱电化学池构型对比
2.2 晶体选择
晶体种类 | 光谱范围(cm-1) | pH 范围 | 折射率(折射率越大,穿透深度越小) |
ATR模式晶体 | |||
Diamond | 525-4000 | 1-14 | 2.42 |
ZnSe | 520-4000 | 5-9 | 2.40 |
Si | 1200-4000 | 1-12 | 3.40 |
Ge | 575-4000 | 1-14 | 4.00 |
外反射模式晶体 | |||
CaF2 | 1100-4000 | 5-8 | 1.43 |
表2 不同晶体物理化学特性
2.3 入射角度
在ATR和外反射测量中,入射角的角度和是否选用偏振光作为光源决定了得到的光谱强度; 理论上,大的入射角度(70-80°)会更好一些。 然而,由于光束在界面上沿着入射角度并且一般电极尺寸在1-2cm直径,当角度在60-80°范围内改变时,没有发现明显的信号增强。 使用60或65°的光路,相同的光路附件可以用于外反射和内反射ATR-SEIRAS。
2.4 正峰和倒峰
红外光谱谱图的展示有吸光度和透过率两种方式,互为向上和向下的关系,便于讨论,假定以吸光度纵坐标,对于某个电位下的参考谱图(通常为一条直线),随电位变化,如果产生正峰(即向上),认为是某种物种生成,若为倒峰(即向下),表示某种物种消耗了。如果针对特定的反应,当某种物种消耗的倒峰解释不通,或者某个范围内的峰一上一下,谱峰出现异常的时候,可能与其他两个因素有关,(1)入射角度(2)金属颗粒(SEIRAS基底或纳米催化剂颗粒)的体积填充因子(volume fraction of the composite occupied by the metal particle),注意:不是颗粒的尺寸。
2.5 光路的选择
目前常用的光路有两种,一种是入射角度(一般为60-70度)固定的光路附件,另一种是入射角度可调节(30-80度)的光路附件。可调角度的光路附件,由于采用了平面镜和非平面的聚焦镜组合,增加了镜片的数量从而增大了光能量的损失,采用一次反射的附件的光路系统,由于没有多次反射减少了能量的损失,得益于高灵敏度的MCT检测器,两种光路均可得到高质量的光谱谱图。
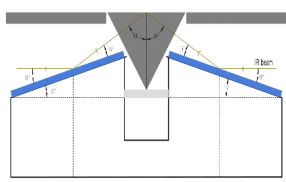
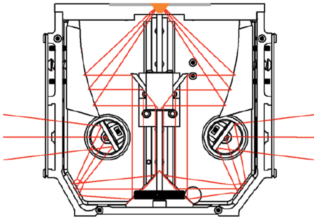
图5 60°入射角光路示意图 图6 VeeMaxIII光路示意图
2.6 电化学池的选择(单腔室和双腔室,流动和静止)
电化学池的种类非常多,有单腔室的(即三电极处在同一腔室内)和双腔室的。Dunwell等人[4]系统研究了电解液纯度和对电极的种类,研究结果推荐:(1)对于CO2电还原,推荐采用双腔室,质子交换膜将对电极和工作电极隔开,以避免对电极产物扩散到工作电极干扰工作电极的反应(2)采用高纯度试剂配置电解液,有时候需要纯化电解液(3)对电极采用碳棒,不采用Pt丝。因为Pt会溶解,可能扩散到阴极,Pt是良好的析氢催化剂。Malkani等人详细对比了流动和静止CO电还原效果,研究表明搅拌的情况下传质更好。但是需要注意的是,实际操作中有些催化剂在强烈对流的状态下会从晶体表面脱落,导致实验无法进展。
ATR-SEIRAS模式,或Kretschmann模式,仅适用于粉末催化剂或在金属膜上电沉积其他催化剂,对于大块电极或碳纸等多孔基底的催化剂无法表征,因此外反射或Otto模式的也偶尔有使用到。
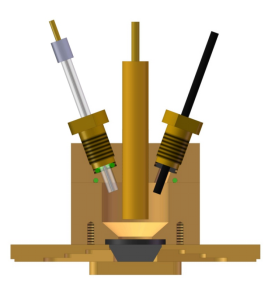
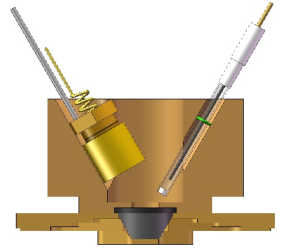
图7 外反射电化学池 图8 小体积内反射双腔室电化学
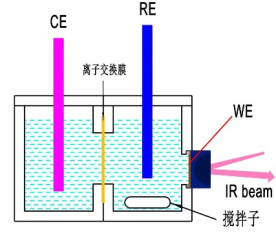
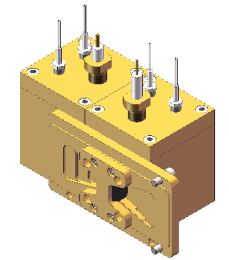
图9 双腔室可搅拌电化学池示意图 图10 双腔室可搅拌电化学池
2.7 表面增强红外注意事项
(1)光谱增强的强度依赖于金属的表面形貌,真空蒸镀和电化学沉积所制备的金属岛状膜都能得到很好的增强效果;
(2)物理吸附和化学吸附的分子都能得到增强,一般情况下化学吸附的分子的增强强度要比物理吸附的分子强;
(3)与金属表面直接相连的第一层分子的信号最强,增强效应随着电极表面距离的增加而衰减,即表面增强是一种短程效应。
SEIRAS基底的制备
许多材料可以用来作为金属沉积的基底,如Ge,Si,ZnSe,CaF2等。增强因子一般和基底材料的折射率以及基底材料本身的化学性质有关,基底本身的化学特性是影响增强效果的很重要因素,因为它决定沉积膜的表面形貌。在每次沉积前对基底的打磨和清洗是保证实验重复性的管件因素,有时候基底的表面修饰也影响增强效果。
(1)干法制备纳米薄膜
主要有真空蒸镀和溅射方式。金属膜的增强效果受形貌,颗粒大小,岛状颗粒密度等因素影响。对于蒸镀,比较低的沉积速率(0.1-0.5nm/min)有利于较好的增强效果。
(2)湿法制备纳米薄膜
化学镀制备得到的金属膜比真空镀的膜岛状纳米离子的粒径要大,化学沉积制备的Au膜与硅基底之间的粘附力要比真空蒸镀的大得多,而且SEIRAS增强因子更大,这可能是因为基底和金膜之间不存在氧化物,即化学镀之前硅表面先用NH4F去除了表面氧化物。另外,增强的电场会在氧化层内发生衰减,因此制备好的金属膜要尽快使用,或者使用前进行电化学清洗
2.8 电化学测试方法的选择
原位电化学红外光谱检测中常用的电化学方法有LSV/CV,计时电流法,单步电位阶跃法,多步骤电位阶跃法,方波伏安法等。根据所选择的电化学方法相应的光谱数据采集有手动采集和自动采集两种。
2.9环境或电解液相关物种谱峰归属
(1)电解液中游离的 HCO3-和 CO32-的信号
1361,1310cm-1 : stretching modes of bicarbonate in solution
1400cm-1 :asymmetric stretching of dissolved carbonate
1650cm-1 : asymmetric C-O stretching mode of bicarbonate ions
(2)H2O的谱图
OH: 3400 cm-1 , HOH bending: 1645-1650 cm-1
由于CO2电还原很多重要的中间体如OCCO,OCCOH,CHO,COOH,COO-峰位置在1300-1800cm-1,正好与以上讨论的HCO3 -和 CO3 2-,H2O峰位置相重叠,而且水在1650 cm-1附近的吸收峰强而宽,可以采用 D2O 配置电解液, 避开 H2O 产生的 1650cm-1 ,
D2O 中的 D-O-D 出峰位置在 1200cm -1
D2O 中的 O-D 出峰位置在 2600cm-1
(3)CO2的谱图
CO2分子中的OCO 不对称伸缩振动会产生2344cm-1的红外吸收峰,需要区分光路反射镜空间和光谱仪主机光路空间中的CO2(即大气中的CO2)和溶液中的CO2(这部分CO2是电还原CO2的反应物),两者峰形状不一样,即溶液中的CO2峰是单峰,大气中的CO2是双峰,从形状上很容易区分两者,如果红外光谱中出现CO2的双峰,即表明大气中的CO2被检测到了,可以通过吹扫达到一个稳定的无大气CO2的基线谱图[3]。
2. 10光路附件和光谱仪的吹扫
由于没有足够吹扫光谱仪和附件,大气中的CO2会被探测到,同时间空气中的水蒸气也可能会被探测到,特别是水中的O-H-O,集中在1610cm-1附近同时会延展到1800 cm-1,会对原位红外谱图谱图质量产生非常不利的影响(增加噪音,掩盖一些中间体的弱峰),因此足够的吹扫非常有必要,通常将光谱仪主机和附件串联,用氮气或压缩空气吹扫,为了获得高质量的谱图,有时候甚至需要提前几个小时大气体流速吹扫。
2.11 电极预处理
某些催化剂在空气中长时间放置溶液被氧化,需要惰性气体氛围或其他条件下保存。有些催化剂需要电化学清洗,如化学镀金或溅射镀金的表面增强基底,一般在高氯酸中通过多次扫CV电化学清洗,然后进行滴涂喷涂或电沉积其他催化剂。
3.红外光谱探测CO2还原应用案例概述
目前采用红外光谱能检测到的CO2电催化还原反应的中间体主要有以下几种:
(1)CO中间体,线性吸附CO:2000-2100 cm-1, 桥式吸附CO:1800 cm-1左右
(2)CHO 1720-1760 cm-1
(3)OCCO1562 cm-1和OCCOH1584 cm-1,1191 cm-1
(4)COOH和COO-
不同催化剂,不同电解液环境,加上stack效应,峰位置会有所偏移。
3.1检测各种中间体
3.1.1 CO中间体
CO既是很多CO2电催化剂催化反应的产物,也是中间产物,同时CO可以作为探针分子,因此探测CO中间体具有非常重要的意义,如通过探测催化剂表面CO吸附构型和各种吸附构型的CO覆盖量,(1)获得CO或CO2与催化剂结合能的强弱,从而调控催化剂向C1或C2+产物选择性,(2)可以间接探测催化剂表面形貌变化过程,催化剂在电催化反应过程中经常发生重构现象,(3)可以探测双电层结构。在很多单金属单晶或多晶电极上观察到CO中间体,如Pt[7], Au[8], Cu[9], Pd[10]等表面。其中 Au, Pd, Cu等表面上可以观察到桥式吸附的CO[9-11]。有研究表明,Cu或Cu氧化物表面[12-13]存在的桥式吸附CO是惰性的,并不能进一步还原成C2+产物,仅仅作为一种旁观中间体,但其覆盖量会影响线性吸附的CO,从而间接影响C2+产物的选择性和催化剂的活性。控制铜表面氧化状态,可以调控线性或桥式吸附CO,从而控制反应选择性[13]。
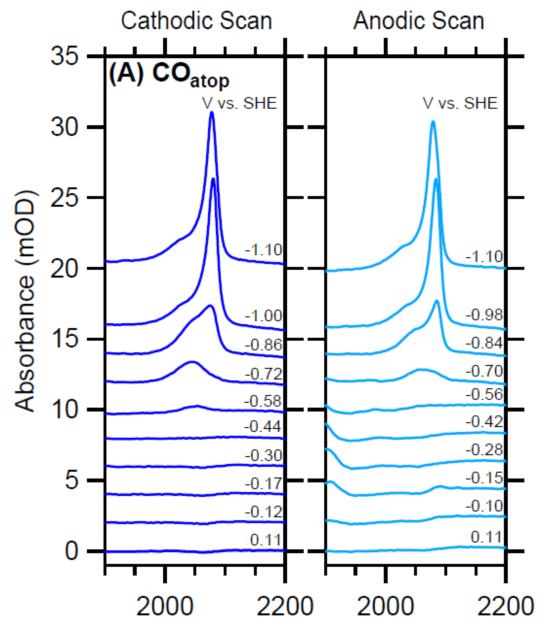
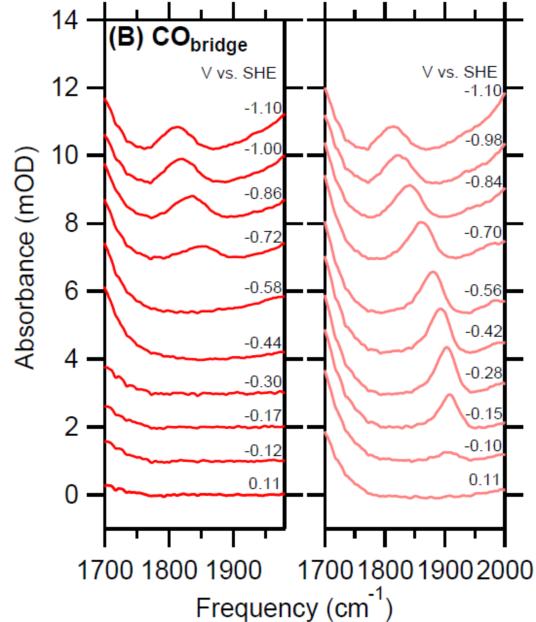
图11 IR spectra of the C≡O stretch mode of (A) COatop and (B) CObridge collected during a CV sweep in CO-saturated 0.05 M Li2CO3 at a scan rate of 10 mV/s. The cathodic forward and anodic backward scans are shown on the left and right panels, respectively【12】.
3.1.2 COOH,COO-中间体
Ag是电催化CO2还原产生CO的非常重要的催化剂,Ag催化剂表面能观察到COOH和COO-中间体[14]。Shuai Chen等人[15]利用Otto-ATR模式,在Au表面也能观察到COO-。
Firet等人[14]采用ATR-SEIRAS研究了Ag表面上CO2电还原路径,在适中的过电势下,确认了质子耦合电子转移的机理,作为主要的CO2反应路径。然而在非常负的电压下,检测到了COO-和COOH中间体,这表明单个的质子和电子转移步骤发生了,在更低的电势下提供一个不同的路径。这些结果表明CO2还原机理依赖于电势而不同。不全部都是包含一个中心的质子耦合电子转移。
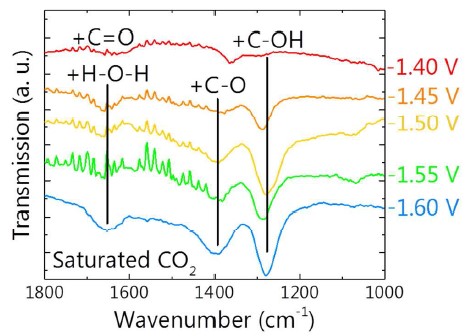
图12 ATR transmission spectra in saturated CO2 0.1 M KCl electrolyte at different potentials showing the peaks that belong to the CO2 reduction intermediates. The background for these spectra was taken after 30 min at the same potential under a nitrogen purge[14]
3.1.3 OCCO和OCCOH中间体
DFT理论计算表明在Cu催化剂表面C2+产物会通过CO中间体二聚从而形成C-C键,但是直接的光谱证据很难捕捉到,也就是OCCO或OCCOH中间体的红外光谱直接观测到的报道并不多见。Koper课题组[16]利用外反射模式原位红外在Cu(100)电极上CO电还原过程中直接观测到CO二聚氢化中概念题OCCOH,1584 cm-1和1191 cm-1。Younghye Kim等人[17]利用ATR-SEIRAS在电沉积的Cu表面和Cu(OH)2-derived Cu表面直接观测到CO中间体独有的二聚形成OCCO(1562 cm-1)中间体路径,而不是经过CHO(1760 cm-1)中间体,同时观测到CHO中间体作为CH4产物的中间体。原位实时测试结果表面CO二聚和线性吸附CO(2057 cm-1)吸附同时进行且较快(约5s),而质子耦合还原形成CHO则较慢(约30S)。这个工作直接观测到了电极表面几种中间体的演化过程,进一步升入了解反应机理。
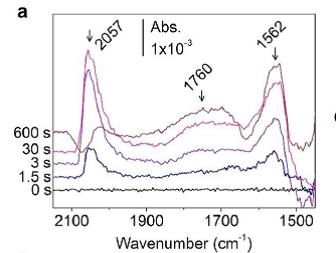
图13 Time-resolved IR spectra with 1.5 s intervals for 10 min The spectra were taken in 0.1 M KHCO3 D2O electrolyte at -0.94 V on (a) ED-Cu,with baseline spectrum at -0.37 V in CO2 saturated electrolyte[17]
3.1.4CHO中间体
CHO中间体红外信号较为微弱,Shangqian Zhu等人[9]在Cu表面直接观察到1720 cm-1,与理论计算的1741cm-1比较接近。Younghye Kim等人[17]也观察到CHO,并实验表明CO吸附形成比CHO更快。
3.2电解液的影响
3.2.1阴离子的影响
很多电催化CO2还原反应是在碳酸氢根电解液中进行,一方面是由于碳酸氢根的pH缓冲能力,另一方面可以作为CO2的来源库。Binjing Xu课题组[8]采用方波伏安电化学方法,ATR-SEIRAS,同位素标记和原位质谱等方法在金表面上系统研究了碳酸氢根的关键角色,研究表明碳酸氢根通过和溶解的CO2达到平衡交换,在金表面形成CO,而不是供给溶解的CO2直接参与反应。作者提出碳酸氢根和溶解的CO2通过快速的平衡从而增加了电极局部附近的CO2浓度从而提高CO的生成速率。Minhua Shao课题组[9]利用同位素标记和ATR-SEIRAS在铜催化剂表面也证明了碳酸氢根离子通过溶解平衡提供CO2从而参与CO2电催化还原,在电极表面形成了线性吸附CO和桥式吸附CO,
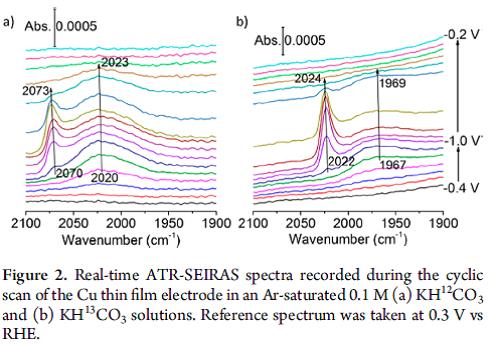
图14 Real-time ATR-SEIRAS spectra recorded during the cyclic scan of the Cu thin film electrode in an Ar-saturated 0.1 M (a) KH12CO3 and (b) KH13CO3 solutions. Reference spectrum was taken at 0.3 V vs RHE [9]
Deng Wanyu等人[18]采用ATR-SEIRAS系统研究了金和铜表面在Ar饱和的KCl和KHCO3电解液中CO2电还原行为,证实了当没有外部CO2共给时来自HCO3-产生了CO的产物。不同于电子排斥,带负电荷的碳酸氢根发现在电极表面附近聚集。碳酸根氢根还原的机理是碳酸氢根不是被吸附在催化剂表面而是通过转化为CO2从而提高电极附近的浓度参与反应。研究还发现CO2电催化活性与本体中碳酸氢根浓度和阴极电势成正比。特别的,局部碳酸氢根浓度受控于阴极电势,最终达到一个平台。
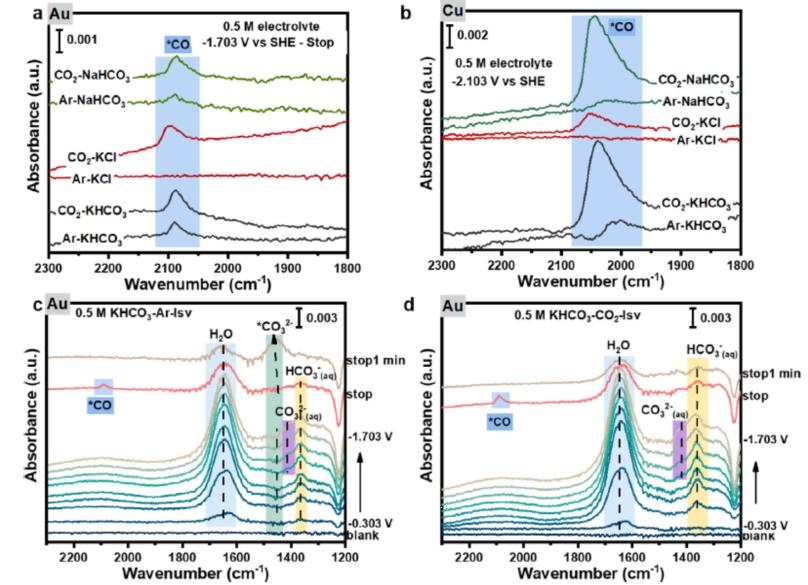
图15 (a) In situ ATR-SEIRAS of Au film recorded after stopping potential at -1.703V in
different solution (b) in situ ATR-SEIRAS of Cu film recorded at -2.103 V in different solution
In situ ATR-SEIRAS of Au film recorded during the LSV test in Ar-saturated (c) and CO2-saturated (d) 0.5 M KHCO3 solution[18].
Guido Mul等人[19]通过调节电解液的组分从而达到调控电解液的pH在铜氧化物表面上系统研究了CO吸附覆盖量。研究表明CO的覆盖量随pH升高而增大,乙烯选择性也相应提高。研究结果强调了乙烯选择性与反应物CO分压和阴离子的组分有关。
3.2.2阳离子的影响
电解液阳离子的性质会影响CO2电还原的法拉第效率和选择性,Singh等人[20]认为这种效应是用于双电层中阳离子水解的缓冲能力造成的差异。他们认为靠近电极表面pKa下降是由于带正电荷的阳离子和带负电的电极表面之间的溶剂化的水分子的极化造成的。Angel Cuesta[21]在金表面上通过原位红外实验证实了这个说法。实验证实了界面上pH随离子尺寸增大而增大的顺序:Li+>Na+>K+>Cs+。电极电解液界面调控至关重要,等人Banerjee等人[22]结合原位红外探测CTAB和不同尺寸碱金属阳离子对界面水的红外吸收和C-H峰,实验观察到带正电荷的表面活性剂分子有效的取代了碱金属阳离子并且抑制了析氢反应。但是当存在CTAB时催化活性和选择性与碱金属阳离子尺寸(Li+, Na+, K+)无关。作者认为CTAB和碱金属阳离子竞争外亥姆赫兹层的位置。乙烯的活性降低了是由于表面活性剂的积累导致界面的疏水性增加。
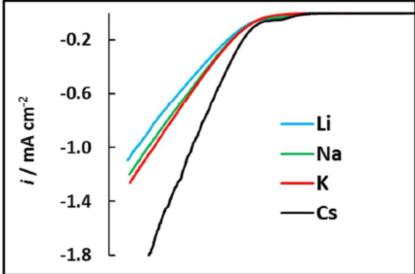
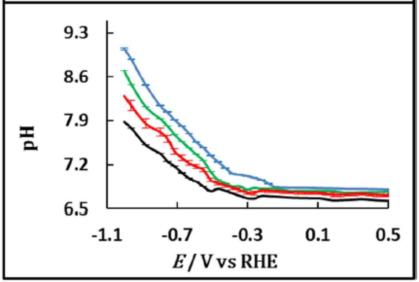
图16 LSVs at 1 mV s-1 (top panel) of a thin-film Au electrode on Si in CO2 -saturated 0.05 M M2CO3 solutions (M = Li (blue), Na (green), K (red), Cs (black)) in D2O, and potential dependence of the interfacial pH[21].
3.2.3 pH值的计算
电解液pH对CO2电催化还原有重要影响,实际上是电极表面局部的pH微观上直接影响CO2电催化还原反应,溶液本体的pH与电催化还原过程中电极局部的pH存在非常大的差别。Dunwell等人[23]采用SEIRAS在金模型催化剂表面,直接原位检测CO2还原过程中电极表面pH变化。通过检测碳酸根(1400)和碳酸氢根(1362)的红外吸收峰面积随电势变化,从而推测局部pH。检测到的界面pH然后结合相关的浓度过电势来检查他们对电动力学的影响。结果表明CO2饱和的NaHCO3溶液,在-1.0V vs.RHE 下电解会产生大于150mV的浓度过电势。增加对流和电解液的缓冲能力可以缓解电极表面的浓度梯度。Smith等人[24]采用在Ge晶体上溅射铜催化剂,采用SEIRAS原位检测电极界面pH,实验表明即使是通常使用的强缓冲能力的磷酸盐缓冲溶液,在电催化CO2还原过程中也不能维持电极界面的pH,即存在电极表面pH升高很多的现象。即使增加磷酸盐的浓度,也不能缓解局部pH变化,增加浓度可能导致析氢反应加剧,而且导致在较窄的电位范围内导致缓冲能力的丧失。
3.3.4电解液添加剂的影响
Papasizza等人[25]报道了金电极上在[EMIM]BF4/H2O mixture (18% mol/mol) CO2还原。结合CV和SEIRAS, 观察到了吸附的CO,随着电位负向增加,CO吸附的覆盖量增大,并且建立了电解液中溶解CO和吸附CO的平衡。红外光谱解释了在界面上存在两种不同的水,Bulk-like water和RTIL-like 水。当存在CO2时,当电位负向增加时,界面上本体水增加了,而RTIL-like 水消耗了。这表明这种类型的水作为CO2电还原的质子供给源。在这个体系中没有观察到EMIM+ -CO2 配合物中间体。
Zhuoqun Zhang等人[26]用SEIRAS来探测CTAB对界面水的影响和CO2还原中间体。HER压制了发现是由于界面水被取代了来自于双电层中CTAB的出现。增强的CO2还原速率可能与增加的线性吸附的CO有关和出现低频的CO峰。这些结果解析了添加剂的作用并且建立作为指导产物选择性的一个有用的方法学。
Dunwell等人[27]采用SEIRAS探测吡啶调节的电解液在Pt催化剂上CO2电催化还原,
不论有无吡啶都观察到COOHL中间体。出现吡啶,COOHL中间体增加了。这也和甲酸和CO产量相一致。提出吸附的COOHL是一般的中间体在形成甲酸和CO的时候。随着电解液中吡啶浓度的增加,COOHL中间体覆盖量相比较于吸附的CO增加了,这与观察到的甲酸盐和CO产量增加相一致。作者提出吸附的COOHL是一个共同的中间体在形成甲酸盐和CO产物中,当出现吡啶的时候,促进了甲酸盐路径。
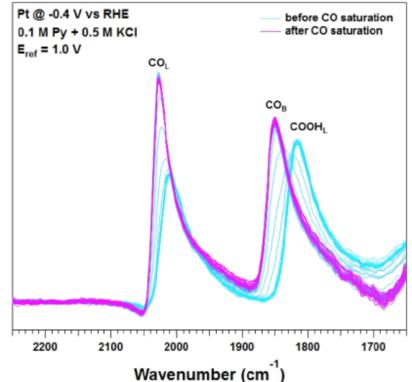
图17 . ATR-SEIRA spectra (4 cm-1 resolution, 8 co-added scans) during potentiostatic electrolysis at -0.4 V 0.1 M Py and 0.5 M KCl on Pt film electrodes Reference spectra were collected at 1.0 V prior to the addition of CO[27].
4.展望
4.1与DEMS联用
仅仅依靠一种分析方法难以全面升入了解CO2电催化反应,原位红外在吸附态中间体上检测有重要应用优势,但是一些挥发性或非红外活性的中间产物或产物,为了为更升入了解电催化还原过程,质谱仪作为物质定性和定量分析强大的工具,原位质谱用于电催化反应是红外光谱表征的一个重要的补充。如原位电化学质谱DEMS在电催化CO2电还原中的应用:
(1)HER,CO2RR竞争反应分析,电流效率计算
(2)气相产物相对法拉第效率快速计算
(3)产物或挥发性中间产物起始生成电位的确认
(4)同位素标记,元素路径的追踪,反应路径解析
(5)快速评价筛选催化剂
Jinyi Li等人[28]采用DEMS和SEIRAS研究了表面吸附的CO和液体反应环境化学和静电相互作用。使用一序列quaternary alkyl ammonium 阳离子(methyl4N+, ethyl4N+, propyl4N+, and butyl4N+),系统调控了液体环境特性。使用DEMS发现在出现methyl4N+和ethyl4N+阳离子时有乙烯生成,而在propyl4N+和butyl4N+两种环境中没有产生。SEIRAS表明阳离子不会阻碍CO吸附位点并且阳离子依赖的界面电场太小了不会影响反应的选择性。SEIRAS表明两个大的阳离子存在时表面吸附CO和界面水发生了分子间的反应不会发生。表明分子间相互作用促进了表面吸附CO的氢化为乙烯。该研究提供关键分子内的洞察力关于表面物种如何和液体环境相互作用,从而控制这个复杂电催化过程的选择性。
Gunathunge等人[29]比较了常用的两种粗糙的铜薄膜电极,发现电化学沉积在化学沉积的金膜上的铜相比于化学沉积的铜,电化学催化还原CO为乙烯的活性要差一些。DEMS表征显示乙烯的起始还原电位:前者更负大约200mV。SEIRAS表明线性吸附的CO峰形呈现明显的区别。
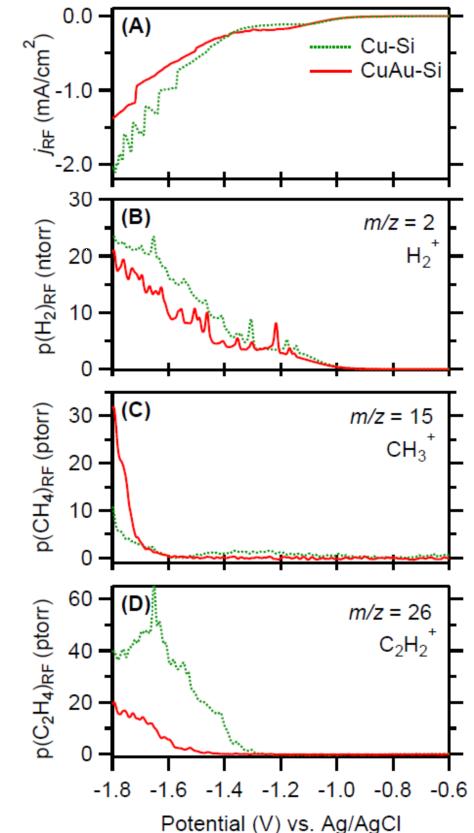
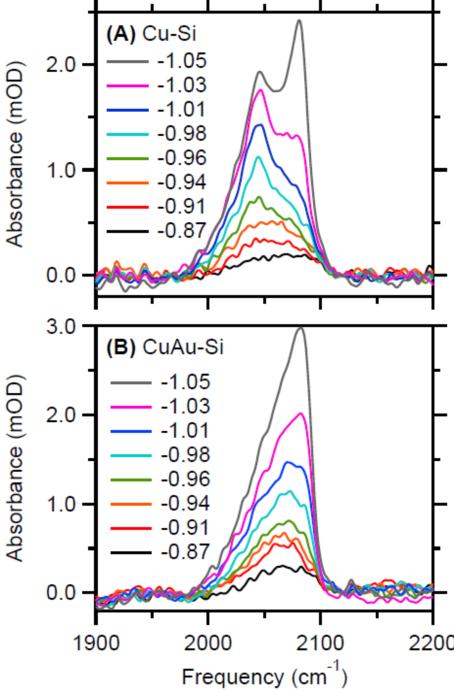
图18 DEMS for Cu-Si and CuAu-Si in contact with CO-saturated 0.1 M potassium phosphate buffer at a pH of 7. (A) Electrochemical current densities. (B) H2+ (m/z = 2), (C) CH3+ (m/z = 15), and (D) C2H2+ (m/z = 26) partial pressures. All signals in this figure were divided by the RF of the respective electrode. Potential-dependence of the C≡O stretch band of COatop on (A) Cu-Si and (B) CuAu-Si. The labels in the panels denote the electrode potential in volts versus the Ag/AgCl reference electrode.
4.2拓展外反射和otto薄层构造流动池
基于金属表面增强基底的SEIRAS虽然获得了较大的成功,但是在某些特殊场合,如碳材料等非金属催化剂,想要探测完全无金属环境的情形,碳纸等负载型催化剂,传统的外反射或Otto-薄层构造的电化学池仍然有重要应用,由于薄层的传质局限性和CO2气体溶解度偏低等原因,通过流动强制对流,传质效果会大幅度提高。
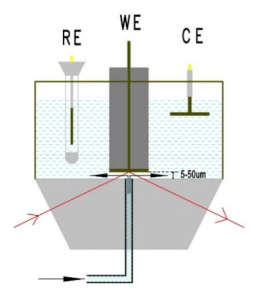
图19 薄层流动原位红外电化学
4.3 MEA电极的原位红外探测
目前,大部分红外光谱原位探测CO2电催化还原反应,还是基于传统的固液两相界面的H型池,但研究电催化活性和选择性(产物法拉第效率计算等),气体扩散电极构造的MEA电极已经开始大量使用,如何探测气固液三相界面,大电流密度下的接近工业实际生产工况下的原位红外探测还少有报道,得益于氢氧燃料电池和直接醇类燃料电池的类似原位红外研究,可以借鉴相关电化学池构造和相关研究方法[30],因此用于电催化CO2还原的接近工业实际生产工况的原位红外探测需要进一步研究开发。
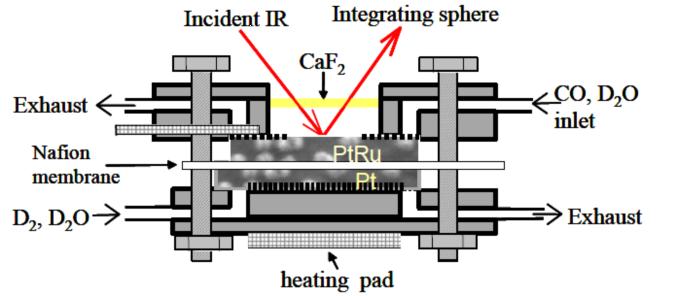
图 20 Schematic of operando IR cell developed by Fan et al[30]
5.参考文献:
Albertus D. Handoko,Fengxia Wei,Jenndy,Boon Siang YeoandZhi Wei She* Understanding heterogeneous electrocatalytic carbon dioxide reduction through operando techniques Nature Catalysis volume 1, 922–934 (2018)
姜艳霞,李 广,叶进裕,李君涛,周志有,孙世刚*电化学原位红外光谱的方法和研究进展 厦门大学学报 第60卷 第2期 2021年3月
Recep Kas, Onagie Ayemoba, Nienke J. Firet, Joost Middelkoop, Wilson A. Smith and Angel Cuesta In-situ infrared spectroscopy applied to the study of the electrocatalytic reduction of CO2: Theory, practice and challenges ChemPhysChem 10.1002/cphc.201900533
Marco Dunwell, Xuan Yang, Brian Setzler, Jacob Anibal, Yushan Yan, and Bingjun Xu Examination of Near-Electrode Concentration Gradients and Kinetic Impacts on the Electrochemical Reduction of CO2 using Surface Enhanced Infrared Spectroscopy ACS Catal. 2018, 8, 5, 3999–4008
Marco Dunwell, Xuan Yang, Yushan Yan and Bingjun Xu Potential Routes and Mitigation Strategies for Contamination in Interfacial Specific Infrared Spectroelectrochemical Studies J. Phys. Chem. C 2018, 122, 43, 24658–24664
Hiroto Miyake, Shen Ye, Masatoshi Osawa Electroless deposition of gold thin films on silicon for surface-enhanced infrared spectroelectrochemistry Electrochemistry Communications 4 (2002) 973–977
T. Smolinka, M. Heinen, Y.X. Chen, Z. Jusys, W. Lehnert, R.J. Behm CO2 reduction on Pt electrocatalysts and its impact on H2 oxidation in CO2 containing fuel cell feed gas – A combined in situ infrared spectroscopy, mass spectrometry and fuel cell performance study Electrochimica Acta 50 (2005) 5189–5199
Marco Dunwell, Qi Lu, Jeffrey M. Heyes, Jonathan Rosen, Jingguang G Chen, Yushan Yan, Feng Jiao, and Bingjun Xu The Central Role of Bicarbonate in the Electrochemical Re- duction of Carbon Dioxide on Gold J. Am. Chem. Soc. 2017, 139, 10, 3774–3783
Shangqian Zhu, Bei Jiang, Wen-Bin Cai, and Minhua Shao Direct Observation on Reaction Intermediates and the Role of Bicarbonate Anions in CO2 Electrochemical Reduction Reaction on Cu Surfaces J. Am. Chem. Soc. 2017, 139, 15664-15667
Tian-Wen Jiang, Ya-Wei Zhou, Xian-Yin Ma, Xianxian Qin, Hong Li, Chen Ding, Bei Jiang, Kun Jiang and Wen-Bin Cai Spectrometric Study of Electrochemical CO2 Reduction on Pd and Pd B Electrodes ACS Catal. 2021,11,840-848
Anna Wuttig, Momo Yaguchi, Kenta Motobayashi, Masatoshi Osawa, and Yogesh Surendranath Inhibited proton transfer enhances Au-catalyzed CO2-to-fuels selectivity PNAS 2016 113,32,E4585-E4593
Charuni Menaka Gunathunge, Vincent John Ovalle, Yawei li, Michael J. Janik, and Matthias M. Waegele Existence of an Electrochemically Inert CO Population on Cu Electrodes in Alkaline pH ACS Catal. 2018, 8, 8, 7507–7516
Tsu-Chin Chou, Chiao-Chun Chang, Hung-Ling Yu, Wen-Yueh Yu, Chung-Li Dong, Juan-Jesús Velasco-Vélez, Cheng-Hao Chuang, Li-Chyong Chen, Jyh-Fu Lee, Jin-Ming Chen, and Heng-Liang Wu Controlling the Oxidation State of Cu Electrode and Reaction Intermediates for Electrochemical CO2 Reduction to Ethylene J. Am. Chem. Soc. 2020, 142, 6, 2857–2867
Nienke J. Firet, and Wilson A. Smith Probing the reaction mechanism of CO2 electroreduction over Ag films via operando infrared spectroscopy ACS Catalysis 2017, 7, 1, 606-612
Shuai Chen, and Aicheng Chen Electrochemical Reduction of Carbon Dioxide on Au Nanoparticles: An In-Situ FTIR Study J. Phys. Chem. C 2019, 123, 39, 23898–23906
Elena Prez-Gallent, Marta C. Figueiredo, Federico Calle-Vallejo, and Marc T. M. Koper Spectroscopic Observation of a Hydrogenated CO Dimer Intermediate During CO Reduction on Cu(100) Electrodes Angew. Chem. 2017, 129, 3675 –3678
Younghye Kim , Sojung Park , Seung-Jae Shin , Woong Choi , Byoung Koun Min , Hyungjun Kim , Wooyul Kim and Yun Jeong Hwang Time-resolved observation of C-C coupling intermediates on Cu electrodes for selective electrochemical CO2 reduction Energy Environ. Sci., 2020,13, 4301-4311
Wanyu Deng , Tenghui Yuan , Sai Chena,b , Huimin Li , Congling Hu , Hao Dong , Bo Wu , Tuo Wang , Jingkun Li, Geoffrey A. Ozin , Jinlong Gong Effect of bicarbonate on CO2 electroreduction over cathode catalysts Fundamental Research 1 (2021) 432–438
Mozhgan Moradzaman and Guido Mul Optimizing CO Coverage on Rough Copper Electrodes: Effect of the Partial Pressure of CO and Electrolyte Anions (pH) on Selectivity toward Ethylene J. Phys. Chem. C 2021, 125, 12, 6546–6554
Meenesh R. Singh, Youngkook Kwon, Yanwei Lum, Joel W. Ager, and Alexis T. Bell, Hydrolysis of Electrolyte Cations Enhances the Electrochemical Reduction of CO2 over Ag and Cu J. Am. Chem. Soc. 2016, 138, 13006–13012
Onagie Ayemoba and Angel Cuesta Spectroscopic Evidence of Size-Dependent Buffering of Interfacial pH by Cation Hydrolysis during CO2 Electroreduction ACS Appl. Mater. Interfaces 2017, 9, 33, 27377–27382
Soumyodip Banerjee, Zhuo-Qun Zhang, Anthony Shoji Hall, and V. Sara Thoi SurfactantPerturbation of Cation Interactions at the Electrode− Electrolyte Interface in Carbon Dioxide Reduction ACS Catal. 2020, 10, 17, 9907–9914
Marco Dunwell, Xuan Yang, Brian P. Setzler, Jacob Anibal, Yushan Yan, Bingjun Xu Examination of Near-Electrode Concentration Gradients and Kinetic Impacts on the Electrochemical Reduction of CO2 using Surface Enhanced Infrared Spectroscopy ACS Catal. 2018, 8, 5, 3999–4008
Kailun Yang, Recep Kas, Wilson A. Smith In-situ Infrared Spectroscopy Reveals Persistent Alkalinity Near Electrode Surfaces during CO2 Electroreduction J. Am. Chem. Soc. 2019, 141, 40, 15891–15900
Marco Papasizza and Angel Cuesta In Situ Monitoring Using ATR-SEIRAS of the Electrocatalytic Reduction of CO2 on Au in an Ionic Liquid/Water Mixture ACS Catal. 2018, 8, 7, 6345–6352
Zhuo-Qun Zhang, Soumyodip Banerjee, V. Sara Thoi Anthony Shoji Hall Reorganization of Interfacial Water by an Amphiphilic Cationic Surfactant Promotes CO2 Reduction J. Phys. Chem. Lett. 2020, 11, 14, 5457–5463
Marco Dunwell, Yushan Yan and Bingjun Xu, In-Situ Infrared Spectroscopic Investigations of Pyridine-Mediated CO2 Reduction on Pt Electrocatalysts ACS Catal. 2017, 7, 8, 5410–5419
Jingyi Lia, Xiang Lia, Charuni M. Gunathunge, and Matthias M. Waegele Hydrogen bonding steers the product selectivity of electrocatalytic CO reduction PNAS 2019 116 19
Charuni Menaka Gunathunge, Jingyi Li, Xiang Li, Julie J Hong, and Matthias M. Waegele Revealing the Predominant Surface Facets of Rough Cu Electrodes Under Electrochemical Conditions ACS Catal. 2020, 10, 12, 6908–6923
Qinbal Fan, Cong Pu, Kevin L. Ley, and E. S. Smotkin In Situ FTIR-Diffuse Reflection Spectroscopy of the Anode Surface in a Direct Methanol/Oxygen Fuel Cell J. Electrochem. Soc., Vol. 143, No.2, L21-L23